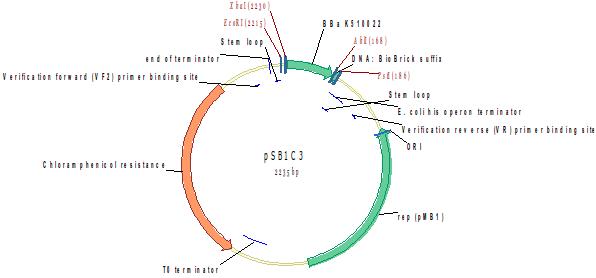
attTn7
Направленная (Single-target) транспозиция бактериальных геномов зависит от наличия консервативной последовательности, включающей 3' конец гена glmS, кодирующего глюкозамин-синтетазу, и часть межгенного региона, обозначаемого как attTn7 site (от «attachment site»). Биоинформатический анализ (Bioinformatic analysis) показал, что этот регион высоко консервативен, и транспозиция Tn7 была продемонстрирована для более чем 20 видов бактерий (Craig, 1996). Отсутствие подходящей мишени является лимитирующим фактором для ряда организмов, в которых не происходит транспозиции Тn7 (бактерий, архей и эукариот). Инсерция фунционального attTn7 в геном этих организмов создает возможность для сайт-специфической транспозиции Tn7, расширяя спектр «хозяев» этого транспозона и его производных, таких как miniTn7 BioBrick toolkit (BBa_K510000, BBa_K510012).
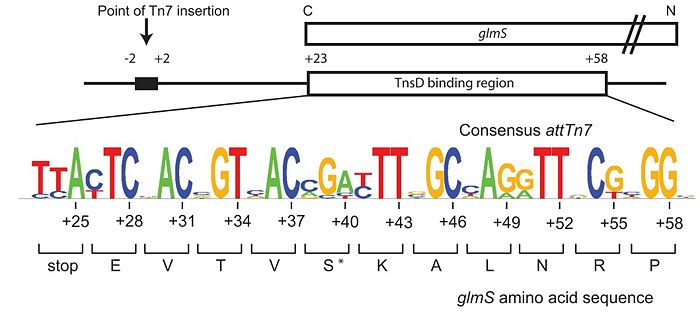
Схема attTn7 (Rupak et al, 2010).
Больше информации здесь: http://parts.igem.org/Part:BBa_K510022:Experience
Источник: http://parts.igem.org/Part:BBa_K510022
Разработчик: David Caballero Group: iGEM11_UPO-Sevilla (2011-09-19)
Выделение плазмидной ДНК
Проводилась трансформация клеток E. coli, штамм Nova-Blue (Novagen). Снятую с агара бактериальную колонию выращивали в среде LB (200 мл) в течении 18 часов. Выделение плазмидной ДНК проводили щелочным лизисом. Дополнительно обрабатывали полученную плазмидную ДНК РНКазой, проводили фенол-хлороформную экстракцию и осаждение этанолом.
Определение концентрации
Методом горизонтального электрофореза (рисунок 101-1, дор.6). Нанесение 1 мкл плазмидной ДНК. Длина линейной формы плазмиды 2235 п.н.
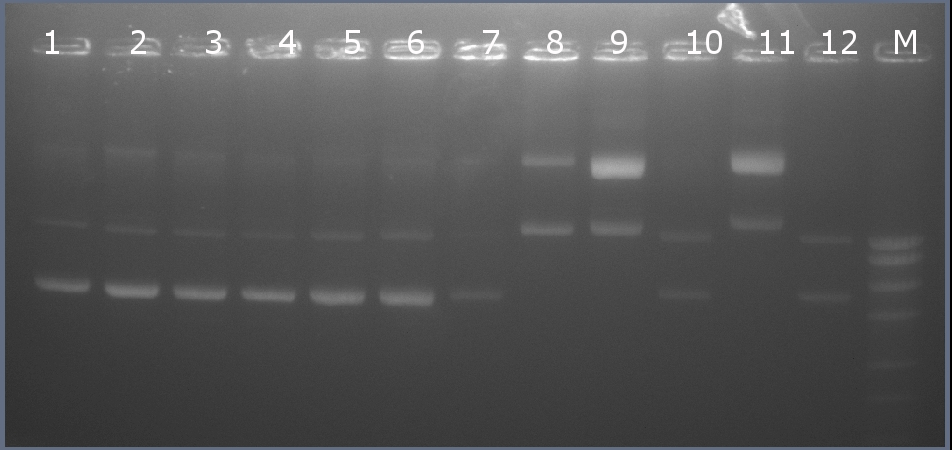
Рисунок 101-1. Электрофореграмма плазмидной ДНК. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).
Рестрикционное картирование
Рестрикционное картирование проводили с помощью эндонуклеаз рестрикции EcoRI, PstI. Разделение продуктов реакции проводили методом вертикального электрофореза в 7% ПААГ (рисунок 10-2, дорожка 6).Ожидаемая длина фрагментов 2029 п.н., 206 п.н.
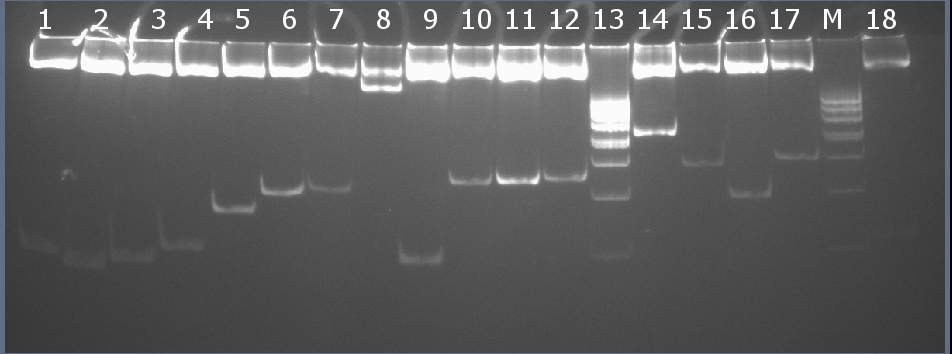
Рисунок 10-2. Электрофореграмма продуктов рестрикции. М – маркерная лестница p400 (100, 200, 300, 400х2, 500, 600, 700, 800, 900, 1000 п.н.).