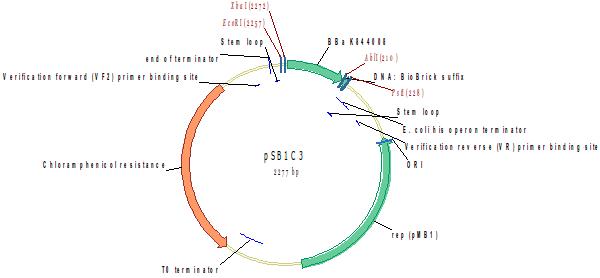
Spider Silk 1x Subunit
Субъединица паучьего шёлка, оптимизированная для использования минимального набора tRNA кодонов (1 кодон на аминокислоту); содержит 2 домена, отвечающих за эластичность, и один домен, отвечающий за прочность, а также 5’ Met (ATG) кодон
Литература:
Brooks AE, Stricker SM, Joshi SB, Kamerzell TJ, Middaugh CR, and Lewis RV. 2008. Properties of synthetic spider silk fibers based on Argiope aurantia MaSp2. Biomacromolecules 9:1506–10.
Источник: http://parts.igem.org/Part:BBa_K844007
Разработчик: Charles Barentine Группа: iGEM12_Utah_State (2012-10-02)
Выделение плазмидной ДНК
Проводилась трансформация клеток E. coli, штамм Nova-Blue (Novagen). Снятую с агара бактериальную колонию выращивали в среде LB (200 мл) в течении 18 часов. Выделение плазмидной ДНК проводили щелочным лизисом. Дополнительно обрабатывали полученную плазмидную ДНК РНКазой, проводили фенол-хлороформную экстракцию и осаждение этанолом.
Определение концентрации
Методом горизонтального электрофореза (рисунок 101-1, дор.11). Нанесение 1 мкл плазмидной ДНК. Длина линейной формы плазмиды 2277 п.н. Не совпадает длина!
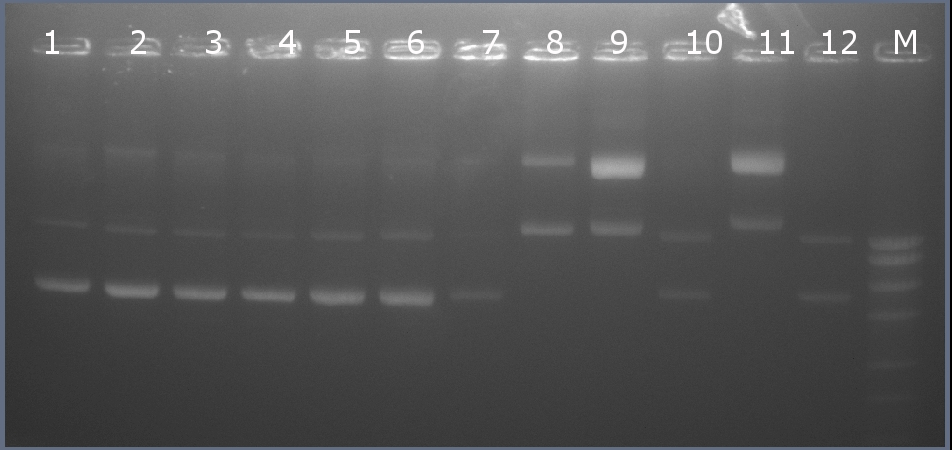
Рисунок 101-1. Электрофореграмма плазмидной ДНК. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).
Рестрикционное картирование
Рестрикционное картирование проводили с помощью эндонуклеаз рестрикции EcoRI, PstI. Разделение продуктов реакции проводили методом вертикального электрофореза в 7% ПААГ (рисунок 10-2, дорожка 11).Ожидаемая длина фрагментов 2029 п.н., 248 п.н.
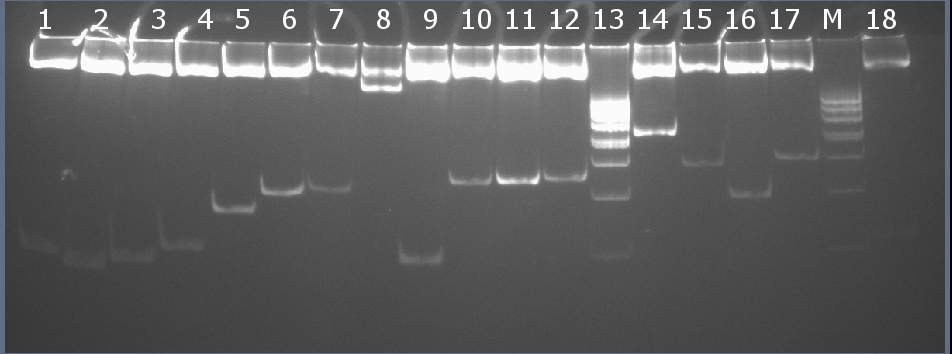
Рисунок 10-2. Электрофореграмма продуктов рестрикции. М – маркерная лестница p400 (100, 200, 300, 400х2, 500, 600, 700, 800, 900, 1000 п.н.).