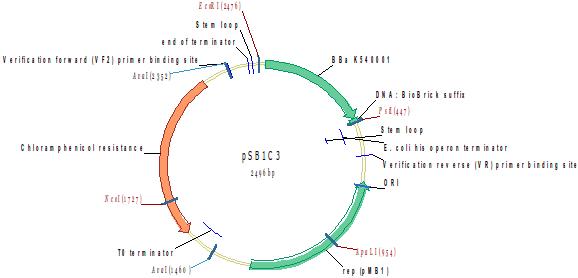
Кобальт-чувствительный промотор
Prcn – промотор, активируемый кобальтом. Репрессор RcnR связывается с промотором по умолчанию. Когда в цитоплазме накапливается достаточное количество кобальта, ионы этого металла связываются с репрессором RcnR и предотвращают его посадку на промотор Prcn.
Prcn также может быть активирован никелем, но мы не характеризовали этот аспект.
Характеризация
Измерение кинетики
Важно: характеризация была проведена не для этого биобрика и не для iGEM Gfp, а для промотора дикого типа. Фрагмент, который мы приводим, имеет точную последовательность промотора, но содержит сайлент-мутацию, ликвидирующую сайт PstI. Используемый здесь GFP является стабильным GFP.
Чтобы установить индуцибельность промотора rcn ионами кобальта, была измерена кинетика флюореаценции (возбуждение 490nm, эмиссия 510nm) для двух следующих штаммов:
- NM522/p157, где p157 – плазмида, содержащая фьюз Prcn-стабильный GFP (= pPROBE OT′ несущий последовательность gfp под контролем промотора rcnA, описано в Appl Environ Microbiol. 2009 March; 75(6): 1723–1733).
- NM522/p115, где P115 – контрольная плазмида pPROBE OT′.
Оба штамма культивировали при концентации кобальта 25µM либо без кобальта. 1ml бактерий добавляли к смеси 100ml среды M63G + 1ml стрептомицина в сосуде объемом 250 ml. Условия культивирования: температура 37°C, перемешивание при 270rpm. Каждый час отбирали образцы объемом 3mL и 1mL для измерения флюоресценции и OD(600nm). Так как мы ожидали увидеть пик экспрессии во время ранней экспоненциальной фазы (личное сообщение Camille Bleriot), в это время образцы отбирали каждые полчаса. Измерения остановили, когда OD достигло 1. Последний образец отобрали после ночи культивирования.
Эксперименты были проведены в 3 повторах разными людьми в течение одного дня. Результаты, показанные ниже, представляют собой средние значения трех повторов.
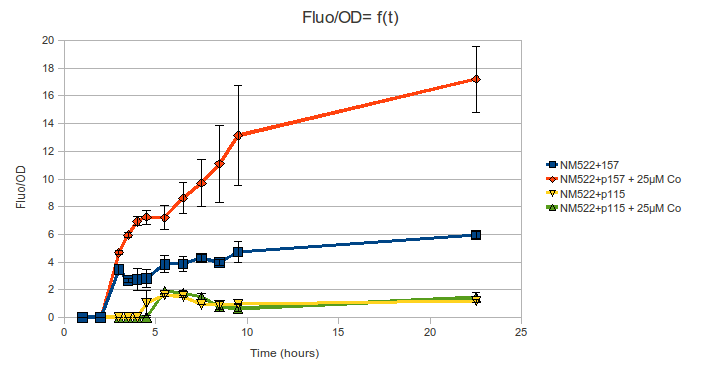
График показывает, что штамм NM522/p115 (несущий контрольную плазмиду) проявляет только остаточную флюоресцентную активность и не отвечает на кобальт, в то время как штамм NM522/p157 (несущий плазмиду с GFP под контролем промотора rcn) хорошо реагирует на кобальт: наблюдается резкое увеличение флюоресцентной активности в присутствии металла. Более того, мы обнаружили, что флюоресцентная активность Prcn-gfp проявляется даже без добавленния кобальта (коэффициент индукции = 3 при добавлении кобальта). Вероятно, это происходит по причине “подтекания” промотора rcn (Camille Bleriot, личное сообщение).
Заключение:
Характеризация промотора rcn показала его способность к индуции кобальтом. Кинетический анализ позволил установить оптимум для активации промотора: OD(600nm) = 0,2.
Таким образом, этот промотор может быть эффективно использован в кобальт-чувствительной системе.
NB: Результаты этой характеризации можно увидеть здесь (фрагмент BBa_K540000,here.)
Дальнейший эксперимент: Чтобы проверить, что активация кобальтом является селективной по отношению к промотору rcn, измерили кинетикудля штамма MC4100, трансформированного плазмидой, содержащей промотор pLac и GFP.Условия культивирования: 100ml среды M63G + 1ml ночной культуры + 1ml ампицилина в сосуде объемом 250 ml. 37°C и 250rpm.
Каждый час отбирали образцы объемом 3mL и 1mL для измерения флюоресценции и OD(600nm).
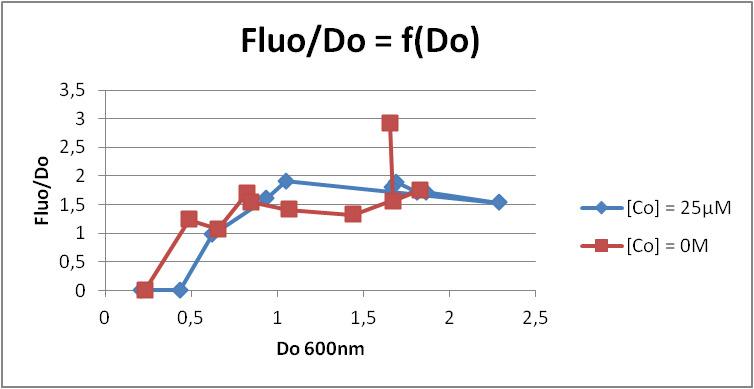
Результаты показывают, что кобальт не активирует промотор pLac. Таким образом, активация кобальтом специфична для rcn-промотора
Безопасность
Этот фрагмент не токсичен сам по себе. Однако при его использовании придется иметь дело с кобальтом, который является токсичным во всех своих формах (в виде иона или металла) при вдыхании, проглатывании или тактильном контакте. Наденьте приспособление для индивидуальной защиты (халат, защитные очки, перчатки) и утилизируйте его в соответствующих контейнерах для отходов
Источник: http://parts.igem.org/Part:BBa_K540001
Разработчик: Разработчик: Mathilde Dumond Группа: iGEM11_LYON-Biosciences_INSA_ENS (2011-09-15)
Выделение плазмидной ДНК
Проводилась трансформация клеток E. coli, штамм Nova-Blue (Novagen). Снятую с агара бактериальную колонию выращивали в среде LB (200 мл) в течении 18 часов. Выделение плазмидной ДНК проводили щелочным лизисом. Дополнительно обрабатывали полученную плазмидную ДНК РНКазой, проводили фенол-хлороформную экстракцию и осаждение этанолом.
Определение концентрации
Методом горизонтального электрофореза (рисунок 1-1, дор.10). Нанесение 1 мкл плазмидной ДНК. Длина линейной формы плазмиды 2496 п.н.

Рисунок 1-1. Электрофореграмма плазмидной ДНК. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).
Рестрикционное картирование
Рестрикционное картирование проводили с помощью эндонуклеаз рестрикции EcoRI, PstI. Разделение продуктов реакции проводили методом горизонтального электрофореза в 1,5% агарозном геле (рисунок 1-2, дорожка 10).Ожидаемая длина фрагментов 2029 п.н., 467 п.н.
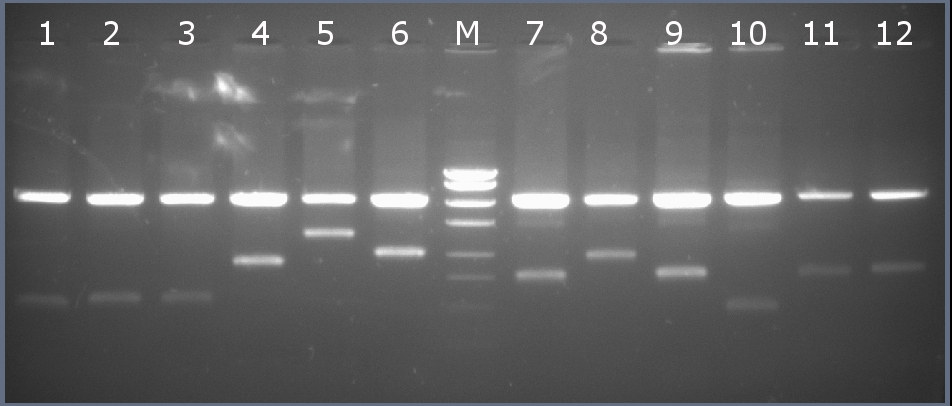
Рисунок 1-2. Электрофореграмма продуктов рестрикции. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).