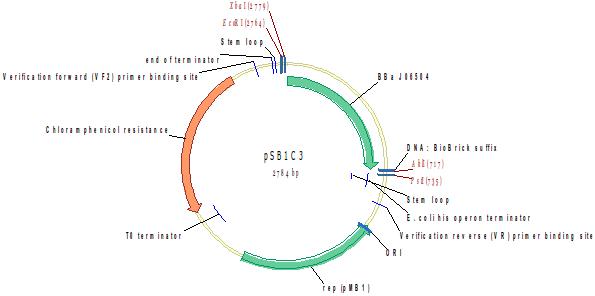
Мономерный красный флюоресцентнйы белок (RFP), оптимизированный для бактерий
BioBrick на основе mRFP1 с удаленным сайтом PstI [mRFP1 является проивзодным от DsRed, получен путем внесения 33 мутаций]
Одним из таких мономерных флюоресцентных белков «второго поколения» является mCherry (Roger Tsien's laboratory at UCSD (cf., Nature Biotechnology 22, 1567 - 1572 (2004). PMID 15558047 )
Источник: http://parts.igem.org/Part:BBa_J06504
Разработчик: ytwang Группа: iGEM2005 (2005-07-18)
Выделение плазмидной ДНК
Проводилась трансформация клеток E. coli, штамм Nova-Blue (Novagen). Снятую с агара бактериальную колонию выращивали в среде LB (200 мл) в течении 18 часов. Выделение плазмидной ДНК проводили щелочным лизисом. Дополнительно обрабатывали полученную плазмидную ДНК РНКазой, проводили фенол-хлороформную экстракцию и осаждение этанолом.
Определение концентрации
Методом горизонтального электрофореза (рисунок 8-1, дор. 1). Нанесение 1 мкл плазмидной ДНК. Длина линейной формы плазмиды 2784 п.н.
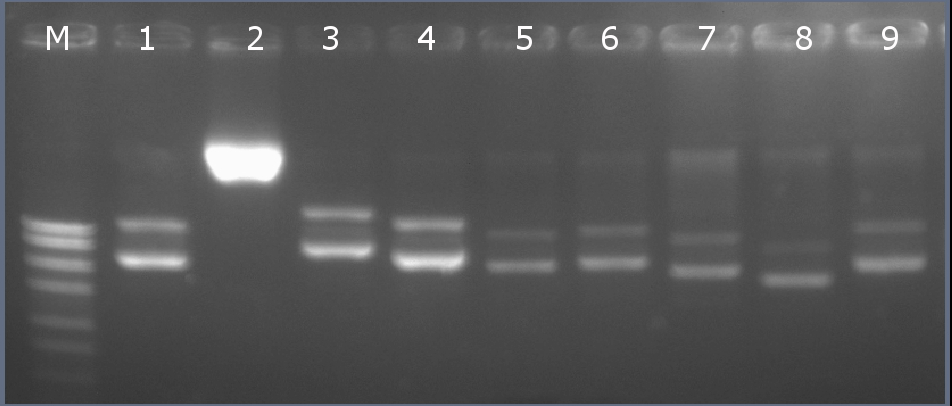
Рисунок 8-1. Электрофореграмма плазмидной ДНК. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).
Рестрикционное картирование
Рестрикционное картирование проводили с помощью эндонуклеаз рестрикции EcoRI, PstI. Разделение продуктов реакции проводили методом горизонтального электрофореза в 1,5% агарозном геле (рисунок 8-2, дорожка 1).Ожидаемая длина фрагментов 2029 п.н., 755 п.н.
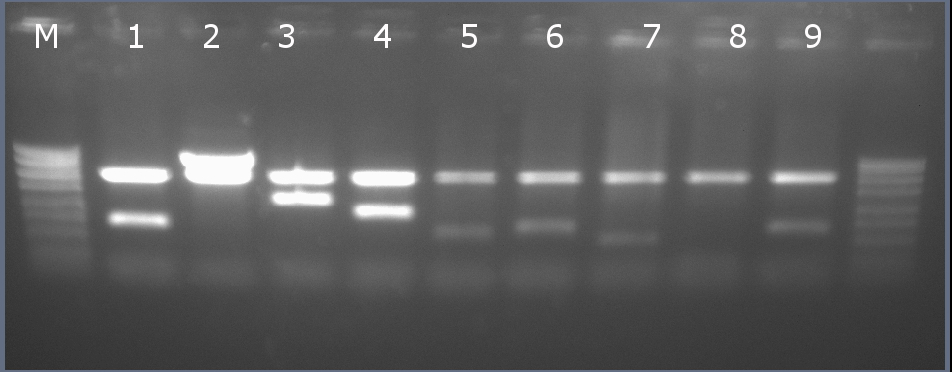
Рисунок 8-2. Электрофореграмма продуктов рестрикции. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).