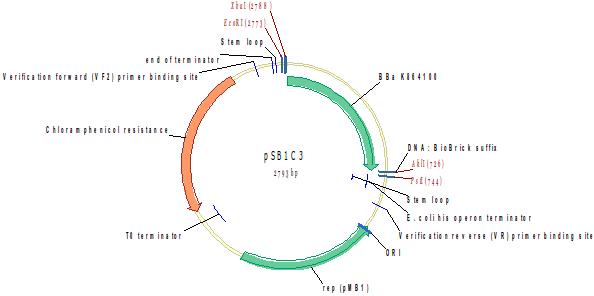
Супержелтый флюоресцентный белок 2 (SYFP2)
Фрагмент кодирует яркий желтый флюоресцентный белок SYFP2. SYFP2 основан на GFP, является мономерным белком с оптимизированным фолдингом, созреванием и узким спектром излучения флуоресценции с максимумом при 515 nm. Бактерии, экспрессирующие SYFP2, в 12 раз ярче бактерий, экспрессирующих g EYFP(Q69K), и почти в 2 раза ярче бактерий, экспрессирующих Venus (Kremer et al 2006). Мутации, отличающие белок от GFP дикого типа (GenBank Accession number M62653): F46L, F64L, S65G, S72A, M153T, V163A, S175G, T203Y и A206K (см. публикацию в списке литературы). Последовательность оптимизирована по кодонам для экспрессии в E coli с помощью DNA 2.0.
Kremers et al приводят следующие данные:
Пик возбуждения: 515 nm. Пик эмиссии: 527 nm. Яркость по отношению к EYFP2(Q96K) в E coli: 12.0. Коэффициент экстинкции (M-1 cm-1): 101000. Квантовый выход: 0.68.
Применение в биологии
Фрагмент может быть использован как репортер.
Литература
[1] Kremers, G.-J., Goedhart, J., van Munster, E. B., & Gadella, T. W. J. (2006). Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Förster radius. Biochemistry, 45(21), 6570–6580. doi:10.1021/bi0516273
Источник: http://parts.igem.org/Part:BBa_K864100
Выделение плазмидной ДНК
Проводилась трансформация клеток E. coli, штамм Nova-Blue (Novagen). Снятую с агара бактериальную колонию выращивали в среде LB (200 мл) в течении 18 часов. Выделение плазмидной ДНК проводили щелочным лизисом. Дополнительно обрабатывали полученную плазмидную ДНК РНКазой, проводили фенол-хлороформную экстракцию и осаждение этанолом.
Определение концентрации
Методом горизонтального электрофореза (рисунок 1-1, дор.7). Нанесение 1 мкл плазмидной ДНК. Длина линейной формы плазмиды 2793 п.н.

Рисунок 1-1. Электрофореграмма плазмидной ДНК. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).
Рестрикционное картирование
Рестрикционное картирование проводили с помощью эндонуклеаз рестрикции EcoRI, PstI. Разделение продуктов реакции проводили методом горизонтального электрофореза в 1,5% агарозном геле (рисунок 1-2, дорожка 7).Ожидаемая длина фрагментов 2029 п.н., 764 п.н.
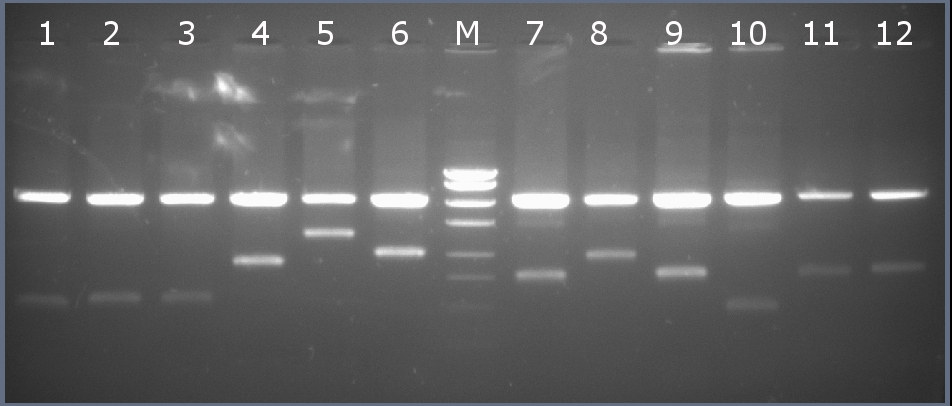
Рисунок 1-2. Электрофореграмма продуктов рестрикции. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).