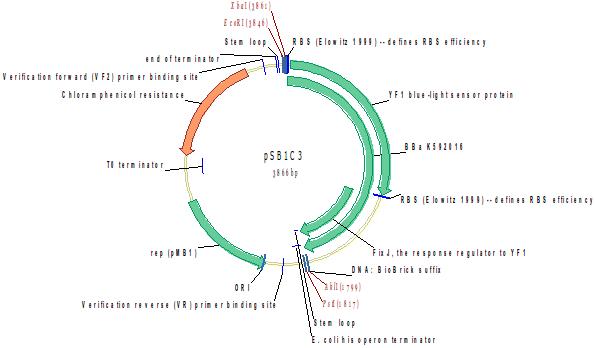
B0034- YF1 blue-light sensor protein-B0034-FixJ, сенсор синего света и RR с сайтом связывания рибосом (RBS)
YF1 представляет собой слитый белок YtvA (B subtilis) и FixL (B japonicum). Он содержит N-концевую область YtvA (1-127) и C-концевую область FixL (258-505), соединенную спиральным линкером. Этот слитый белок разработан Андреасом Могличем и Кейтом Моффатом. В своей статье они показали, что освещение гибридной киназы YF1 приводит к снижению активности в ~ 1000 раз in vitro (Moglich A, Ayers RA and Moffat K. (2009) Design and Signaling Mechanism of Light-Regulated Histidine Kinases. J. Mol. Bio. 385, 5, 1433-1444). Они также показали, что YF1 контролирует экспрессию гена свето-зависимым образом in vivo. Фрагмент состоит из YF1 и FixJ с RBS, но без промотора и регулятора.
Источник: http://parts.igem.org/Part:BBa_K592016
Разработчик: Lei Sun Группа: iGEM11_Uppsala-Sweden (2011-09-21)
Выделение плазмидной ДНК
Проводилась трансформация клеток E. coli, штамм Nova-Blue (Novagen). Снятую с агара бактериальную колонию выращивали в среде LB (200 мл) в течении 18 часов. Выделение плазмидной ДНК проводили щелочным лизисом. Дополнительно обрабатывали полученную плазмидную ДНК РНКазой, проводили фенол-хлороформную экстракцию и осаждение этанолом.
Определение концентрации
Методом горизонтального электрофореза (рисунок 2-1, дор.9). Нанесение 1 мкл плазмидной ДНК. Длина линейной формы плазмиды 3866 п.н.
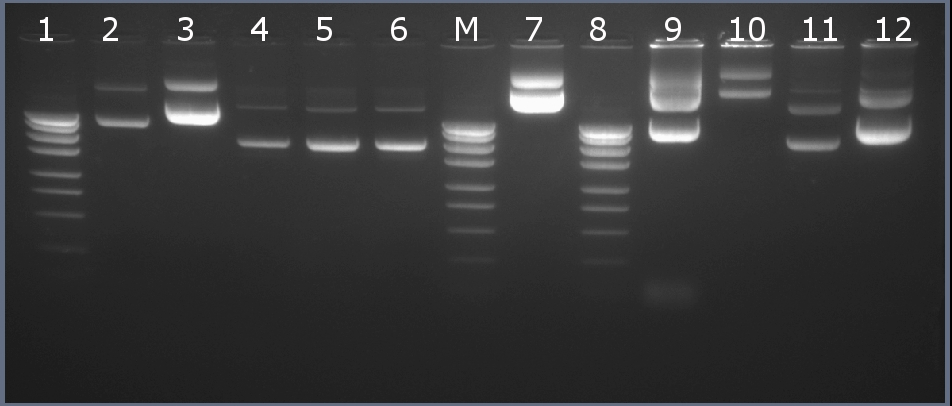
Рисунок 2-1. Электрофореграмма плазмидной ДНК. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).
Рестрикционное картирование
Рестрикционное картирование проводили с помощью эндонуклеаз рестрикции EcoRI, Bsp19I. Разделение продуктов реакции проводили методом горизонтального электрофореза в 1,5% агарозном геле (рисунок 2-2, дорожка 9).Ожидаемая длина фрагментов 2597 п.н., 749 п.н., 491 п.н. (виден фрагмент недореза 1240 п.н.)
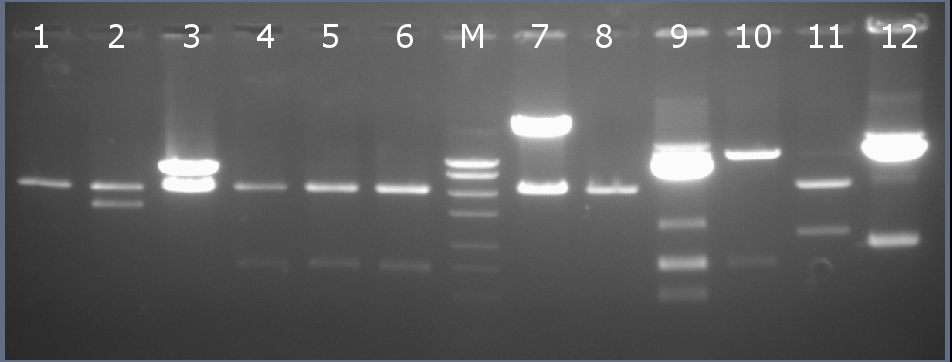
Рисунок 2-2. Электрофореграмма продуктов рестрикции. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).