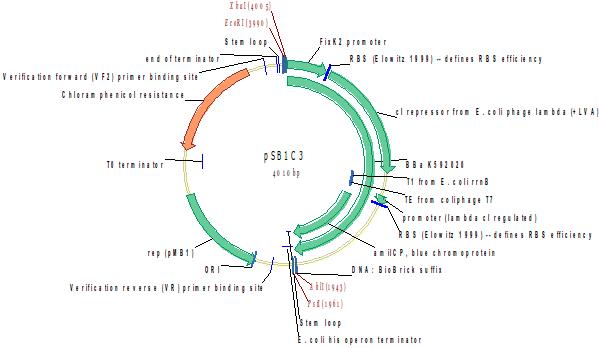
PFixK2-lambda C1-B0034-amilCP blue light sensor output
FixK2 промотор - downstream сигнальный промотор YF1/FixJ (сенсорной системы синего света). Система YF1/FixJ становится неактивной при освещении синим светом и инактивируется в темноте. Такая система неудобна, поэтому за промотор FixK2 был встроен инвертор. YF1 в темноте фосфорилируется и активирует FixJ (его собственный RR). FixJ связывается с промотором FixK2, что приводит к транскрипции lambda C1, репрессирующего amilCP. На свету YF1/FixJ не влияет на промотор FixK2, концентрация lambda C1 падает, и продуцируется amilCP.
Источник: http://parts.igem.org/Part:BBa_K592020
Разработчик: Lei Sun Группа: iGEM11_Uppsala-Sweden (2011-09-21)
Выделение плазмидной ДНК
Проводилась трансформация клеток E. coli, штамм Nova-Blue (Novagen). Снятую с агара бактериальную колонию выращивали в среде LB (200 мл) в течении 18 часов. Выделение плазмидной ДНК проводили щелочным лизисом. Дополнительно обрабатывали полученную плазмидную ДНК РНКазой, проводили фенол-хлороформную экстракцию и осаждение этанолом.
Определение концентрации
Методом горизонтального электрофореза (рисунок 2-1, дор.10). Нанесение 1 мкл плазмидной ДНК. Длина линейной формы плазмиды 4010 п.н.
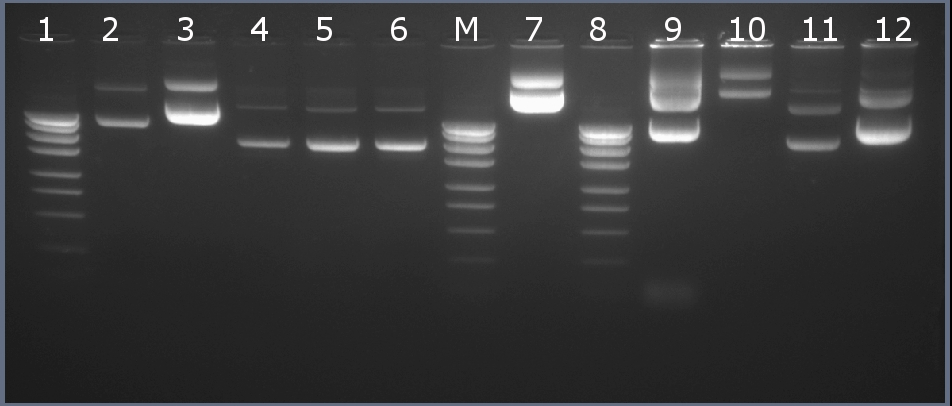
Рисунок 2-1. Электрофореграмма плазмидной ДНК. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).
Рестрикционное картирование
Рестрикционное картирование проводили с помощью эндонуклеаз рестрикции EcoRI, HindIII. Разделение продуктов реакции проводили методом горизонтального электрофореза в 1,5% агарозном геле (рисунок 2-2, дорожка 10).Ожидаемая длина фрагментов 3236 п.н., 774 п.н.
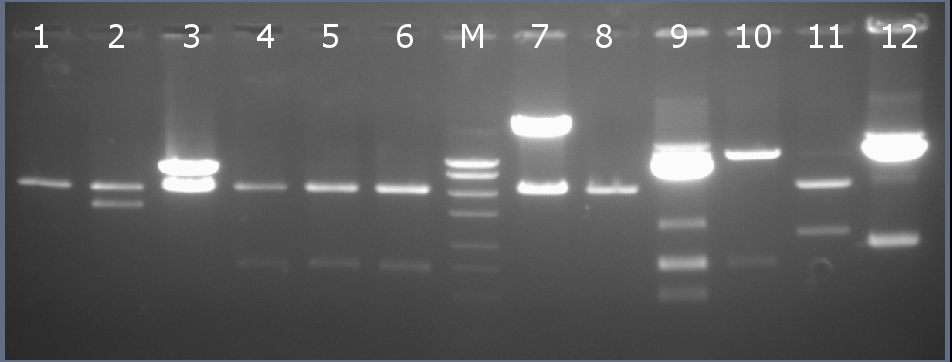
Рисунок 2-2. Электрофореграмма продуктов рестрикции. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).