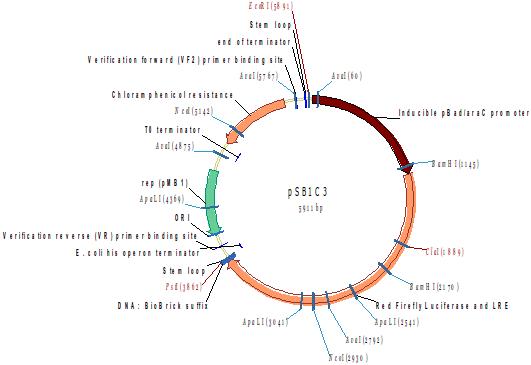
Красная люцифераза светлячка и and LRE (under pBAD) L.Cruciata (E. coli optimised)
Фрагмент содержит красный мутантный белок люциферазы от японского светляка (L.cruciata), а также регенерирующий фермент люциферина (LRE). Он находится под контролем индуцированного арабинозой промотора. Для получения светового потока необходимо добавить D-Luciferin.
Светоизлучающая реакция включает превращение D-Luciferin в оксилюциферин. Это соединение конкурирует с D-Luciferin для сайта связывания lucifearase, вызывая сильное ингибирование активности фермента. LRE удаляет оксилюциферин из системы, превращая его в 2-циано-6-гидроксибензотиазол (CHBT). Это соединение не ферментативно превращается в D-люциферин в присутствии D-цистеина. Было предложено, чтобы в естественной системе L-цистеин использовался для получения L-Luciferin, который затем изомеризуется в D-Luciferin, но это не может быть воспроизведено командой Cambridge iGEM 2010 года.
Светоизлучение также может быть достигнуто добавлением CHBT и D-цистеина вместо D-Luciferin, но D-цистеин может иметь пагубные последствия для роста клеток и физиологии.
Люциферин-регенерирующий фермент превращает оксилюциферин в CHBT. CHBT конвертируется в люциферин в присутствии D-цистеина
Фрагмент оптимизирован по кодонам для экспрессии в E.coli.
Источник: http://parts.igem.org/Part:BBa_K325219
Разработчик: Bill Collins and Emily Knott Group: iGEM10_Cambridge (2010-09-15)
Выделение плазмидной ДНК
Проводилась трансформация клеток E. coli, штамм Nova-Blue (Novagen). Снятую с агара бактериальную колонию выращивали в среде LB (200 мл) в течении 18 часов. Выделение плазмидной ДНК проводили щелочным лизисом. Дополнительно обрабатывали полученную плазмидную ДНК РНКазой, проводили фенол-хлороформную экстракцию и осаждение этанолом.
Определение концентрации
Методом горизонтального электрофореза (рисунок 3-1, дор.2). Нанесение 1 мкл плазмидной ДНК. Длина линейной формы плазмиды 5911 п.н.
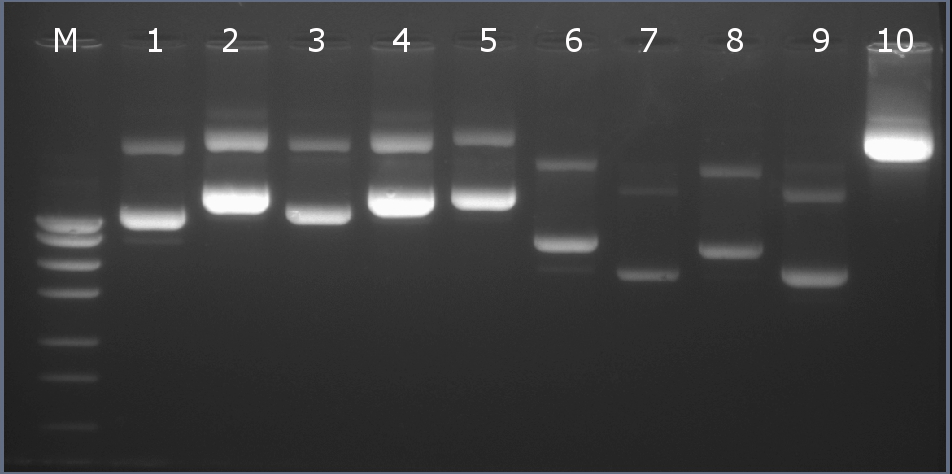
Рисунок 3-1. Электрофореграмма плазмидной ДНК. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).
Рестрикционное картирование
Рестрикционное картирование проводили с помощью эндонуклеаз рестрикции EcoRI, PstI. Разделение продуктов реакции проводили методом горизонтального электрофореза в 1,5% агарозном геле (рисунок 3-2, дорожка 2).Ожидаемая длина фрагментов 2029 п.н., 3863 п.н.
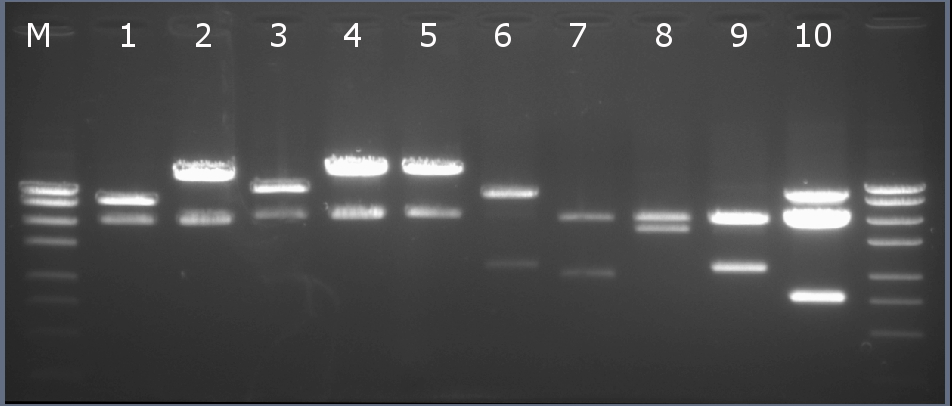
Рисунок 3-2. Электрофореграмма продуктов рестрикции. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).