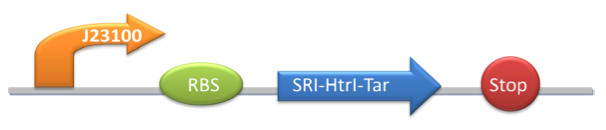
Сенсорный родопсин I (SRI) с HtrII & Tar, чувствительный к оранжевому свету
К сенсорному родопсину I с помощью линкерного пептида пришит домен HtrII, а цитоплазматический домен замещен на домен Tar. Используется для индукции фототаксиса при освещении оранжевым светом (560-600 nm) и регуляции экспрессии downstream генов.
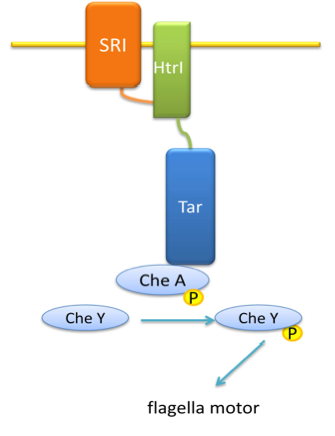
- HtrII – белок-преобразователь SRI, принадлежит к семейству Mетил-accepting chemotaxis protein-Like Proteins (MLP), содержит домен–медиатор сигнальной трансдукции к «мотору» жгутика [8].
- Tar – белок семейства Mетил-accepting chemotaxis protein-Like Proteins E. coli, отвечает за распознавание аспартата [7]. Регулирует гистидин-киназу (CheA), которая в свою очередь регулирует CheY – «переключетель» мотора жгутика. Таким образом происходит
Источник: http://parts.igem.org/Part:BBa_K786003
Разработчик: Leung Wai Tak Группа: iGEM12_Hong_Kong-CUHK (2012-09-21)
Выделение плазмидной ДНК
Проводилась трансформация клеток E. coli, штамм Nova-Blue (Novagen). Снятую с агара бактериальную колонию выращивали в среде LB (200 мл) в течении 18 часов. Выделение плазмидной ДНК проводили щелочным лизисом. Дополнительно обрабатывали полученную плазмидную ДНК РНКазой, проводили фенол-хлороформную экстракцию и осаждение этанолом.
Определение концентрации
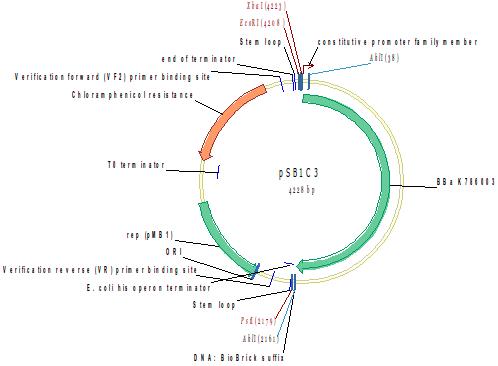
Методом горизонтального электрофореза (рисунок 6-1, дор. 4). Нанесение 1 мкл плазмидной ДНК. Длина линейной формы плазмиды 4228 п.н.
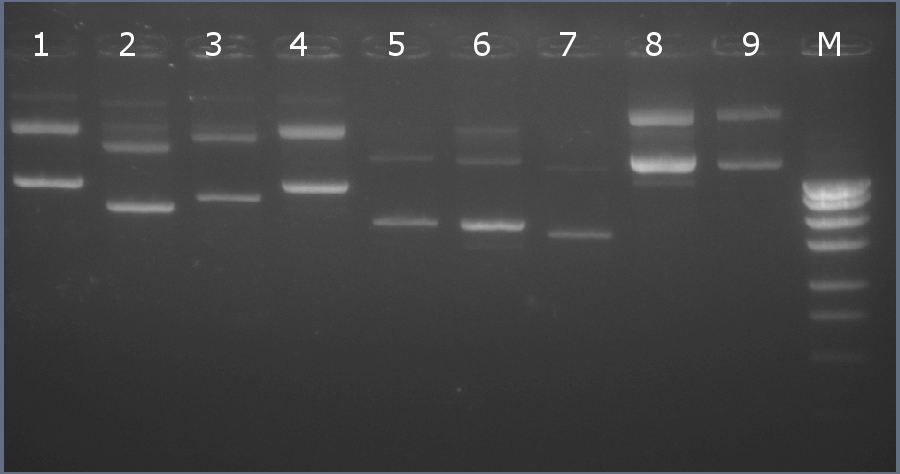
Рисунок 6-1. Электрофореграмма плазмидной ДНК. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).
Рестрикционное картирование
Рестрикционное картирование проводили с помощью эндонуклеаз рестрикции EcoRI, PstI, EcoRV. Разделение продуктов реакции проводили методом горизонтального электрофореза в 1,5% агарозном геле (рисунок 6-2, дорожка 4).Ожидаемая длина фрагментов 2029 п.н., 1136 п.н., 896 п.н.
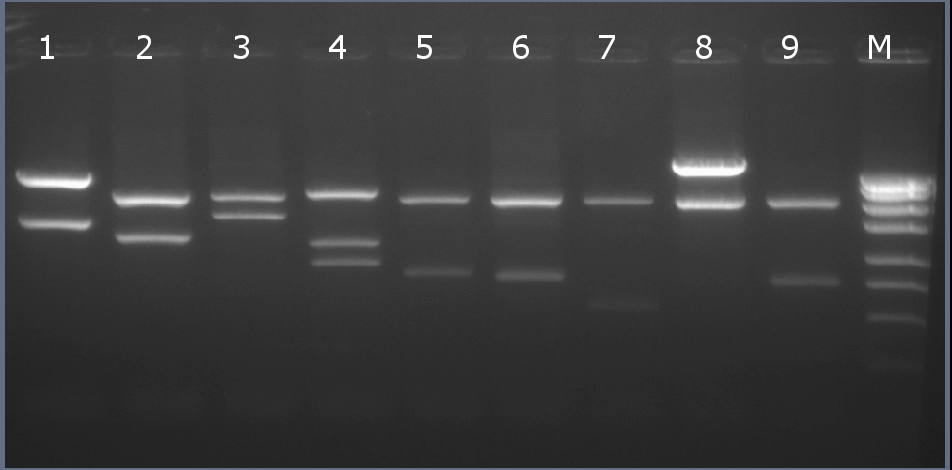
Рисунок 6-2. Электрофореграмма продуктов рестрикции. М – маркерная лестница p250 (250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н.).